生物透射电镜是观察生物细胞样品内部形态的重要工具,其电压在80-120kv可以降低生物样品因高能电子束辐射而损伤的影响,同时依赖于生物样品制备技术的发展,如超薄切片技术、负染色技术、冷冻制样技术、细胞化学技术等,广泛应用于组织学、细胞学、病毒学、病理学及材料学等多个学科的研究中。一般用来观察细胞整体结构、细胞膜、细胞壁、细胞器等亚显微结构变化、材料进入细胞内部的分布情况或者细胞应付外界刺激产生的自噬小体等结构,以及外界生物入侵的侵染结构等。
1. 送样要求
(1)细胞样品用1.5ml的尖底管,离心成团(至少黄豆大小),加入2.5%戊二醛固定液(缓慢加入电镜固定液,不要将细胞吹散。若将细胞吹散,请离心3000转,保持细胞成团状)。固定液加满离心管,使样品完全浸没在固定液中,放置于4°C固定12h后,用泡沫盒加冰袋低温保存运输,注意:样本管与冰袋隔开,固定液切勿冷冻结冰。 (细菌样品要求同细胞)
(2)组织样本:肠、血管、皮肤、肌肉等有方向性样本需切成1mm*3mm*0.5mm长方体小块(如下图B),要观察的面为横切面(1mm*0.5mm),使用2mL离心管加满2.5%戊二醛固定液;无方向性的组织,如肝脏、肾脏、肺脏等可切成1mm³立方体小块(如下图A),使用2mL离心管加满2.5%戊二醛固定液,放置于4°C固定12h后,用泡沫盒加冰袋低温保存运输。注意:样本管与冰袋隔开,避免固定液结冰。固定液渗透能力有限,超出此范围后组织会无法完全固定,后续实验无法完成,请务必重视此过程。 特别注意:取材时尽量精确到需要观察的目的部位(如观察肾小球取肾皮质;观察胰岛取胰岛丰富的胰尾;皮肤,肠胃等在固定液中易打卷的组织可将组织粘在滤纸上进行固定)。
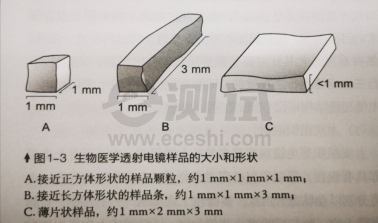
(3)植物样本:取材流程:PBS冲洗样品,确保无泥沙等污染物。然后用锋利刀片或剪刀将样品切成合适大小,装入预冷的植物及细菌电镜专用2.5%戊二醛中。不需要定位的样品切成1立方毫米大小(如叶片、果实、花粉等),需要定位的样品,切1mm×3mm×0.5mm的长条状(茎、根、表皮等)随后抽气,让组织能沉淀到管底。充分固定后,用泡沫盒加冰袋低温保存运输,注意:样本管与冰袋隔开,固定液切勿冷冻结冰。
(4)打印填写完整的实验预约单和样品一起寄送;
(5)无法承接磁性样本,敬请谅解。
2.测试周期 一般为样品接收后的2-3周左右,如遇法定假期需要顺延,具体实验周期及送样时间请与e测试工作人员沟通确认,谢谢!
3.交付数据 每样提供10张拍摄图片(不提供分析服务)。如需更多照片请提前与工作人员沟通确认,并且会产生额外费用,请悉知!结果反馈请在测试完成一周内,不建议回收样品,可回收制备好的包埋快和铜网,如有需要请提前反馈给e测试工作人员。
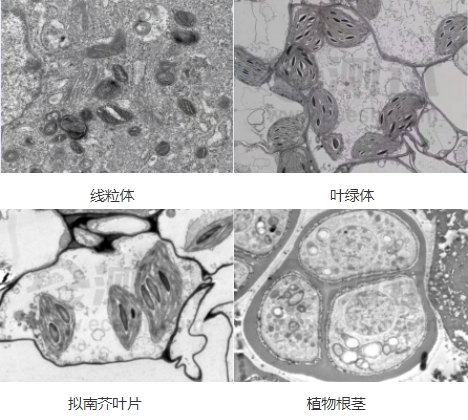
参考图
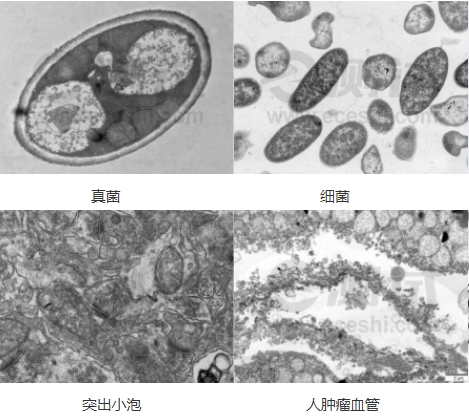
1、植物的根部为什么有时看不到细胞核?
植物细胞的细胞核相对比较小,不好切,切片的时候有可能没有切到,所以在观察透射电镜的时候会发现看不到细胞核。
2、2.5%戊二醛固定液如何配置?
市售25%戊二醛水溶液 10ml
0.1mol/L二甲砷酸钠 50ml
蒸馏水加至 100ml
3、切片染色的目的是什么?
由于生物样品主要由碳、氢、氧、氮等轻元素组成。这些元素原子对电子的散射能力很弱,相互之间的差别也很小。尤其生物超薄切片被树脂所包埋,这些包埋树脂对电子的散射能力与样品本身差别很小。因此生物样品超薄切片观察时像的反差极弱。为了提高图像的反差,要对超薄切片进行电子染色。这里所谓电子染色是根本不同于光学显微镜的染色,它是利用重金属盐(如铅盐、铀盐等)与细胞的某些成分或结构结合,由于重金属对电子散射能力很强,使那些与其结合的结构或成分对电子散射能力增强,从而达到提高样品本身反差。目前最常用的染色剂是醋酸铀和柠檬酸铅染色液。
4、负染色背景杂乱可能是什么原因导致的
样品中有其它的杂质(如杂蛋白,酶,糖,甚至前期处理留下的盐(PPS))都有可能造成背景比较脏乱,或染液在干燥时分布不均匀导致,这些都是在负染时的正常现象。
5、负染色的样本用哪种染料比较好?
磷钨酸对病毒的染色效果比较好;醋酸铀(乙酸双氧铀)常用于蛋白质的染色,对一些病毒样品负染色效果也较好,但由于醋酸铀pH(4.5)比较低,不适于在该pH(4.5)下不稳定的蛋白质染色,同时醋酸铀与磷酸盐易形成结晶,因此可能影响染色效果,可以多清洗几次。
6、生物电镜样本的取样建议?
取材是电镜实验的第一步,其操作成功与否直接关系到电镜结果的效果及成败。为了得到好的结果,请务必按要求做好取材!取材基本要点:快(1min)、冷(4℃)、小(1 mm3)、净(无杂质)、准(部位准确)。不同的样品,取材细节上有很大区别!取材部位准确,且注意观察组织的方向性和定位。动作轻巧,器械锋利,避免对组织的挤压和推拉,建议用锋利的手术刀片、手术剪刀。

 当前位置:首页 > 科研服务> 显微成像平台> 生物透射电镜(生物TEM)
当前位置:首页 > 科研服务> 显微成像平台> 生物透射电镜(生物TEM) 
 仪器型号
仪器型号








