一、实时荧光定量PCR(qPCR)原理
实时荧光定量PCR(quantitative real-time
PCR,qPCR)是指在PCR体系中加入荧光染料或荧光探针,利用荧光信号积累实时监测整个PCR进程,最后通过CT值和标准曲线对未知模板进行定量分析的方法。具有PCR技术快速、灵敏的特点,同时还具有更高的特异性、实时监测和可重复精确定量等优势。
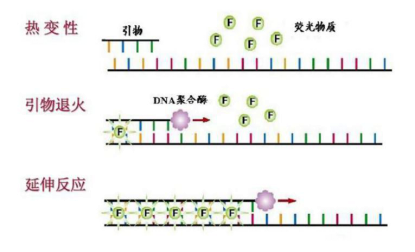
荧光染料法:实验设计简单(仅需2个引物,无需设计探针),初始成本低,灵敏度高,但需要进行熔解曲线分析检验扩增反应的特异性。适用于非特异性检测(专一性要求不高或高通量检测)。
探针法:有高特异性(引物和探针共同于模板结合),高信噪比,能进行多重反应。但成本高,实验设计繁琐。适用于扩增序列专一检测。
二、qPCR的实验流程
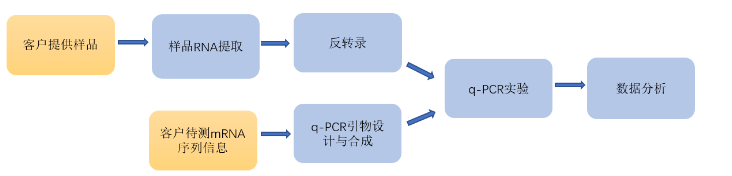
1、引物设计
引物设计原理:
(1)用于qPCR的引物长度一般在20-25 bp,TM值一般在60℃左右(TM值很重要)。
(2)扩增的目的片段长度建议在150-250 bp(通常80-300 bp均可,引物二聚体的长度为30-40
bp,因此目的片段长度过低无法跟引物二聚体区分)。
(3)如果文献中有qPCR的引物报道可以直接采用文献中的引物序列,也可以自己设计。常用的引物设计软件有Oligo6、Primer
Premier等。
2、样本准备:RNA提取+逆转录
(1)RNA提取与检测:从生物样本中提取总RNA,并通过电泳、光谱分析或RNA定量仪等方法检测其质量和浓度。
(2)逆转录(RT):对于检测mRNA,需先进行逆转录反应,将RNA转化为cDNA,作为后续qPCR的模板。
3、qPCR反应体系
qPCR反应体系构建
(1)模板:加入适量已知浓度的cDNA或待测DNA模板。• 引物:设计并添加针对目标基因特异性序列的正向和反向引物。
(2)荧光检测体系:根据所选方法,添加相应的荧光染料(如SYBR Green)或荧光探针。
(3)酶与缓冲液:包含热稳定DNA聚合酶(如Taq酶)、Mg离子和其他必要的缓冲成分。
(4)水:补足体积至最终反应体系。
qPCR循环
(1)热循环参数:设置一系列温度循环,包括变性(95°C左右,使DNA变性为单链)、退火(不同温度,使引物与模板结合)和延伸(72°C左右,合成新链)步骤。每个循环后,仪器记录荧光信号强度。
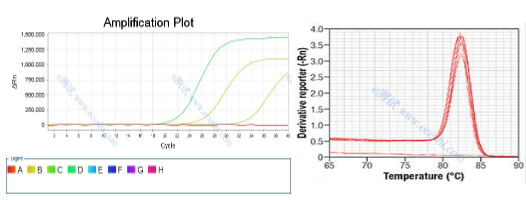
(2)熔解曲线分析(仅适用于DNA结合染料法):在PCR结束后,通过逐步升高温度并监测荧光信号,得到熔解曲线,用于验证扩增产物的特异性和判断是否存在非特异性扩增产物。
4、数据分析
三、qPCR的结果展示
四、qPCR的常见问题
1、实时荧光定量 PCR 的优点包括那些?
(1)能够实时监控 PCR
反应的进程;(2)能够精确测定每个循环的扩增片段数量,从而对样本中的起始材料量进行准确定量;(3)具有更大的检测动态范围;(4)在单管中实现扩增和检测,无需
PCR 后处理。
2、给我司送样做qPCR的送样要求是什么?
(1)A:细胞、细菌、真菌、动植物组织等均可寄送,为了保证实验要求,样品数尽可能准备充足。

注意事项 1. 组织在1-2min内完成取材,速冻,并立即放入-80℃或液氮中保存。
2. 有条件的话,最好先将样本在液氮中速冻,再转入-80℃冰箱中保存。
3. 使用的冻存管最好也用DEPC处理。
4. 对于组织及细胞样本,如果没有液氮或-80℃冰箱,也可用RNAlater保存,但是组织一定要切成比较小的块状,-20℃保存运输。
B:细胞沉淀:细胞量大于10^6的细胞/组;细菌沉淀:细菌量大于10^8的细菌/组;
C:土壤、污泥样本:至少10g;
D:环境水样:至少1L/组,寄送装有过滤定量水样的滤膜(4°C),干燥寄送。
如果其他样品寄送需求,请与工作人员沟通确认!
(2)待测样品为RNA样品及cDNA样本,RNA浓度不低于200ng/uL,DNA浓度不低于20ng/uL,核酸体积10uL/检测基因,且样品接收后需先进行质检,质检合格的开展后续项目(核酸样本需包装完整,离心管用封口膜封闭,干冰寄送)。
(3)不接受具有致病性的样品。
(4)待测样品(原始样品或者RNA或者cDNA,原始样品可由我们代处理,RNA样品及cDNA样本接收后需先进行质检,质检合格的开展后续项目);
(5)提供所需的引物/标准品(或平台代设计及合成);提供检测基因的序列和引物序列,若基因序列来自文献等其他途径,可以多参考几组,避免引物特异性不足,延长实验周期。
(6)其他所涉及的细胞、试剂盒以及生物耗材等平台都可以有偿提供。
3、熔解曲线出现双峰的原因?
引物设计不够优化:应避免引物二聚体和发夹结构的出现。
引物浓度不佳:适当降低引物的浓度,并注意上下游引物的浓度配比。
镁离子浓度过高:适当降低镁离子浓度,或选择更合适的 mix 试剂盒。
模板有基因组的污染:RNA提取过程中避免基因组DNA的引入,或通过引物设计避免非特异扩增。
4、CT值出现太晚,偏大?
扩增效率低: 反应条件不够优化。设计更好的引物或探针;改用三步法进行反应;适当降低退火温度;增加镁离子浓度等。
PCR各种反应成分的降解或加样量的不足。
PCR产物太长: 一般采用80-150bp的产物长度。
5、阴性对照出现明显扩增 反应体系污染:更换新的Mix、ddH2O、引物重复实验。反应体系在超净工作台内配制,减少气溶胶污染。
引物二聚体的出现:配合熔解曲线进行分析。
6、qPCR的相对定量法计算?
(1)目的基因Ct值的归一化:
ΔCt(实验组)=Ct(实验组的目的基因)-Ct(实验组的内参基因)
ΔCt(对照组)=Ct(对照组的目的基因)-Ct(对照组的内参基因)
(2)实验组ΔCt的归一化:ΔΔCt=各样本的ΔCt-对照组的ΔCt
(3)表达水平的差异倍数:2 –ΔΔCT
