蛋白质含量的测定是生物化学、分子生物学、临床医学以及食品科学等多个领域中不可或缺的基本实验步骤。准确测量蛋白质浓度对于保证下游实验如Western Blot、ELISA、免疫沉淀等实验结果的可靠性至关重要。
1、Bradford法(考马斯亮蓝):Bradford法基于蛋白质与考马斯亮蓝G-250染料在特定条件下形成稳定的复合物,其最大吸收峰会发生显著变化,通过分光光度计测定吸光值的变化即可计算出蛋白质浓度。
(1)实验准备
- 准备不同已知浓度的标准蛋白溶液以绘制标准曲线。
- 配制Bradford试剂(市售即用型或按厂家说明配制)。
(2)操作步骤
- 取若干微孔板,每孔加入一定量待测蛋白样品及一系列标准蛋白溶液。
- 向各孔加入等体积的Bradford试剂,混匀后在室温静置一段时间(通常为5-10分钟)。
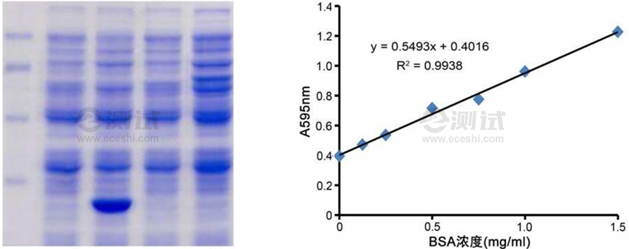
- 使用分光光度计在595nm波长下测定各孔的吸光值。
- 以标准蛋白浓度为横坐标,以对应的吸光值为纵坐标,绘制标准曲线。
2、BCA法:基于双缩脲原理,碱性条件下蛋白质将Cu2+还原成Cu+,BCA鳌合Cu+作为显色剂,产生蓝紫色并在562nm有吸收峰,单价Cu+与蛋白质呈剂量相关性。可以根据待测蛋白在562nm处的吸光度计算待测蛋白浓度。
(1)实验准备
- a. 取0.8ml蛋白标准配制液加入到一管蛋白标准(20mg BSA)中,充分溶解后配制成25mg/ml的蛋白标准溶液。配制后可立即使用,也可以-20ºC长期保存。
- b. 取适量25mg/ml蛋白标准液,稀释至终浓度为0.5mg/ml。例如取20µl 25mg/ml蛋白标准,加入980µl稀释液即可配制成 0.5mg/ml蛋白标准。蛋白样品在什么溶液中,标准品也宜用什么溶液稀释。但是为了简便起见,也可以用0.9% NaCl或PBS 稀释标准品。稀释后的0.5mg/ml蛋白标准可以-20ºC长期保存。
(2)操作步骤
- a. 将标准品按0、1、2、4、8、12、16、20µl加到96孔板的标准品孔中,加标准品稀释液补足到20µl,相当于标准品浓度分 别为0、0.025、0.05、0.1、0.2、0.3、0.4、0.5mg/ml。
- b. 加适当体积样品到96孔板的样品孔中。如果样品不足20µl,需加标准品稀释液补足到20µl。请注意记录样品体积。
- c. 各孔加入200µl BCA工作液,37ºC放置20-30分钟。 注: 也可以室温放置2小时,或60ºC放置30分钟。BCA法测定蛋白浓度时,颜色会随着时间的延长不断加深。并且显色反 应会因温度升高而加快。如果浓度较低,适合在较高温度孵育,或适当延长孵育时间。
- d. 用酶标仪测定A562,或540-595nm之间的其他波长的吸光度。
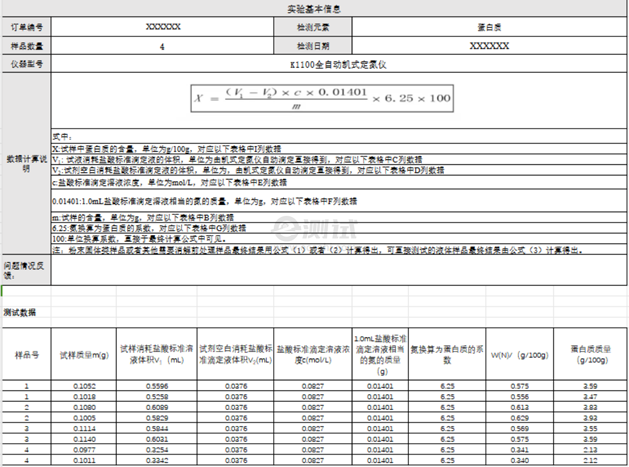
- e. 根据标准曲线和使用的样品体积计算出样品的蛋白浓度。 3、凯氏定氮法 它是通过测定样品中的总氮含量间接反映蛋白质总量的一种方法,因为蛋白质含氮量相对恒定(约16%)。当样本与浓硫酸共热,蛋白氮转化为铵盐,在强践行条件下将氨整出,用加有指示剂的硼酸吸收,最后用标准酸滴定硼酸,通过标准酸的用量即可求出蛋白质中的含氮量和蛋白质含量。 总结来说,不同的蛋白含量测定方法各有优劣,选择合适的方法取决于实验需求、灵敏度要求以及可能存在的干扰因素。在实际操作时,务必遵循安全操作规程,并对实验结果进行必要的校正和验证。
样本量要求:3-5g或者5-10mL,为防止蛋白样品降解,需低温寄送保存,避免反复冻融。
服务周期:一般为样品接收后的1周,具体实验周期及送样时间请与e测试工作人员沟通确认,谢谢!
交付内容:提供原始数据及图片。结果反馈请在测试完成一周内,不建议回收样品,如有需要请提前反馈给e测试工作人员。
用凯氏定氮法测试蛋白,如果同时有两种蛋白怎么换算?
同时含有多种蛋白质,且折算系数不相同时可以按复合配方食品换算蛋白质系数。凯氏定氮法经典、准确,适用于食品中蛋白质的测定。但是因样品中一般会含有一些非蛋白质的含氮化合物,所以凯氏定氮法测定结果为样品中粗蛋白质含量。然而,此法实际上测的不是蛋白质含量,而是通过测氮含量来推算出样品中蛋白质的含量。

 仪器型号
仪器型号