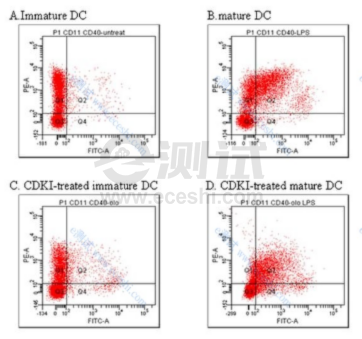
1.简介:
流式细胞术(flow cytometry,FCM)是利用流式细胞仪对于处在快速直线流动状态中的细胞或生物颗粒同时进行多参数、快速定量分析和分选的高新技术。其特点是:第一,只要样本制备成单个细胞或生物颗粒悬液均可以分析。第二,测量速度快,每秒中可以测量数千个乃至数万个细胞。第三,同时测量每个细胞的多参数特征。
2.样品处理:(以流式周期为例)
⑴细胞收集:弃去上清,加入 PBS清洗一次,再加入胰酶消化细胞,加入PBS终止消化,用移液枪轻轻吹打细胞,制备细胞悬液,700 rpm离心5 min收集细胞。
⑵PBS洗涤细胞:加入PBS重悬细胞,700 rpm离心5 min,混匀。
⑶固定过夜:加入预冷的75%乙醇,重悬细胞,4℃过夜固定。
⑷PBS洗涤细胞:加入2 ml PBS混匀后,700rpm离心5 min收集细胞,PBS重悬,离心收集细胞。加入100 ul PBS重悬细胞。
⑸去除RNA:加入2 μl 浓度为1 mg/ml 的RNaseA(去离子水配制),37℃水浴40 min。
⑹荧光标记:加入100 µl浓度为100 µg/ml 的PI染色液(PBS配制),避光染色20 min。
⑺上机检测:流式细胞仪使用激发波长488 nm,发射波长585±21 nm进行检测,用flowj软件分析细胞周期以确定细胞周期分布。
1.样本制备:
(1)不需要细胞、细菌等处理的样本
a:可直接上机测试的样本(已有荧光),根据样本性质避光4℃或者常温保存;
b:样本需要进行染色处理后上机测试,根据样本性质避光4℃或者常温保存,标明染色试剂盒和测试条件,若需要特殊染色试剂盒,请自行提供或本公司代为购买.
(2)需要制样处理的样本
样本需要和细胞/细菌共培养,用染色剂处理之后上机测试。
a:液体类。根据测试时样本浓度和检测时间点而定,按照单次检测需要的3-5倍的量寄送样本;若采用稀释后样本测试,则须告知稀释倍数及工作液浓度;若溶剂为有机溶剂(如DMSO,醇类,酚类等),最高工作液浓度中,溶剂的占比低于0.5%。
b:粉末类。送样量根据测试时样本浓度和检测时间点而定,按照单次检测需要的3-5倍的量寄送;
①可溶性粉末:注明溶剂的种类(如无水乙醇,异丙醇,DMSO,培养基,PBS或者生盐水等),当样品对溶剂有特殊需求时,请在送样时附加所需溶剂;
②不可溶粉末:注明样本性质,灭菌方式,及分散为均匀悬浮液所需必要步骤。
c:块体类—薄膜、布料、金属块、纸片、凝胶等
送样量:该类样本处理方式建议为先铺细胞,再放材料(适用于材料轻薄);或者浸提处理,可参考国标ISO 10993-12 2007中的浸提方式浸提,根据浸提方式按量和检测时间点提供;
制样要求:若是需要把细胞接种到材料上的话,金属块、凝胶类样本须制备成统一大小的圆形/方形,建议制备直径为30-33 mm圆形。布料、纸片类样本可代为裁剪,默认制备直径为32 mm。
2.请务必认真填写预约单各项内容,标明分组情况和测试条件等,寄送样品时请您附带一份送样单。
3.用parafilm膜将样本管密封后置于50毫升离心管或类似容器里,旋紧盖子。样品包装请套上自封袋,且尽量将样品置于缓冲物如泡沫垫、棉花、冻存盒内,以免运输过程中损坏。
4.流式细胞术一般每个样品上机检测2次,以验证样品均一性和仪器稳定性,务必寄送可以满足一次以上实验的样品量,以免反复寄送,如所需样品量不清楚请及时前期对接技术顾联系。
5.原则上不接收邮寄细菌、藻类、真菌、细胞等需要直接上机检测的样品,因为在邮寄过程中样品状态发生变化会导致检测结果不准确,如有需要,请联系e测试工作人员。
1、细胞体外放置多久仍可染色?
若细胞来不及处理,只有表面染色,细胞可放在4℃ 6~12 h,对染色结果影响不大;若是胞内因子的染色需要及时处理,因细胞有刺激过程,需要细胞保证活性。对于凋亡染色、线粒体膜电位分析及检测胞内酶活性必须要及时染色。
2、细胞固定后能染色吗?
建议固定后不要染色,因甲醛固定后会导致某些抗原表位的丢失(甲醛固定时细胞氨基基团会发生交联,从而掩盖抗原的表位),另外,残留的甲醛会和抗体分子非特异性结合,这些都会导致染色效率不高;若因不可抗拒原因需要固定后染色,一定要清楚固定后抗原是否受影响(可实验验证),建议PBS洗涤细胞两次后染色。
3、如何正确选择及使用同型对照?
购买抗体时一定要知道该抗体的种属来源以及亚型,同型对照应该选择与该抗体种属来源一样、亚型一样以及颜色标记一样的,因为抗体有不同的克隆号,在购买时选择性比较多,所以我们应当尽量购买已有同型对照对应的抗体,同型对照的使用量应该与对应抗体的使用量一致,注意这里的量不是指的体积,而是指的抗体含量(重量),因此需要我们根据同型对照的浓度来换算最终加入的同型对照的体积。

 当前位置:首页 > 科研服务> 细胞生物平台> 流式细胞分析仪(Flow Cytometry)
当前位置:首页 > 科研服务> 细胞生物平台> 流式细胞分析仪(Flow Cytometry) 
 仪器型号
仪器型号