JC-1线粒体膜电位检测的步骤
细胞培养与处理:
根据实验设计,培养细胞至所需密度,并进行任何特定的处理(如药物处理)。
细胞固定与染色(对于固定细胞):
如果检测的是固定细胞,需要使用适当的固定剂固定细胞。
对于活细胞,则不需要固定步骤。
JC-1探针制备:
按照说明书配制JC-1工作液,通常为5 μM的浓度。
细胞染色:
将JC-1工作液加入到细胞培养基中,按照说明书推荐的时间进行孵育(通常为15-30分钟)。
洗涤步骤:
孵育完成后,用PBS或其他适宜的缓冲液洗涤细胞几次,以去除未结合的JC-1。
荧光检测:
可以使用荧光显微镜观察细胞,并分别记录红色和绿色荧光图像。
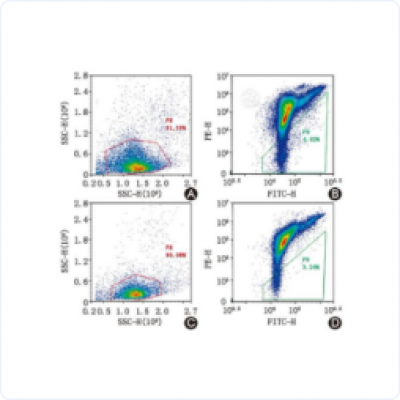
也可以使用流式细胞仪或荧光酶标仪进行定量分析。
数据分析:
计算红色荧光强度与绿色荧光强度的比值,以此作为线粒体膜电位的相对指示。
对于流式细胞仪的数据,通常会生成荧光强度直方图,可以进一步分析不同细胞群体的分布情况。
注意事项
在使用JC-1进行检测时,确保严格按照制造商提供的说明书操作。
选择适当的荧光通道进行检测,避免交叉干扰。
控制实验条件的一致性,确保结果的可比性。
如果是活细胞检测,注意温度和培养条件对细胞的影响。
JC-1检测线粒体膜电位是一种非常有用的工具,广泛应用于细胞生物学和医学研究中,尤其是在研究细胞凋亡机制、药物筛选等方面。不过,在进行实验设计时,还需要考虑其他可能影响线粒体膜电位的因素,如细胞类型、培养条件等。
